维生素D缺乏症的大流行:诊断、治疗和预防方法
汪子伟 编译
摘要:维生素D缺乏和不足是一个全球健康问题,影响着全世界10亿多儿童和成人。维生素D缺乏的后果是不能低估的。维生素D缺乏与许多急性和慢性疾病有关,包括先兆子痫、儿童龋齿、牙周炎、自身免疫性疾病、传染病、心血管疾病、致命癌症、2型糖尿病和神经系统疾病。本综述旨在对维生素D缺乏和不足的定义所引发的争议进行全面的审视,并为如何治疗和预防维生素D缺乏提供指导。
1.维生素D缺乏和不足的定义
直到1998年,维生素D缺乏才以25-羟基维生素D(缩写为25(OH)D)的血液水平来定义;即25-羟基维生素D2和25-羟基维生素D3的总浓度小于10 μg/L (25 nmol/L)。这一定义主要基于血液25(OH)D水平与佝偻病发展相关的报道[1]。人们还认识到,维生素D缺乏与循环中的甲状旁腺激素(PTH)水平增加有关的报道,血清PTH水平和25(OH)D水平呈负相关,在25(OH)D大约30μg/L时PTH水平开始进入平台[2]。1998年Malabanan 等人报道,当健康成年人血液中25(OH)D水平为11 ~25 μg/L 被给予50,000IU的维生素D2每周一次、连续8周,他们观察到25(OH)D血液水平在11~19 μg/L之间的成年人PTH水平有统计学意义的下降,而25(OH)D血液水平在20~25 μg/L之间的成年人PTH水平没有明显变化[3]。因此,在1998年维生素D缺乏被重新定义为25(OH)D < 20 μg/L[3]。
自1998年以来,已有多项研究报道了血清PTH水平与血清25(OH)D水平的关系。Thomas等人在医院人群中报道,当25(OH)D约为30μg/L时,PTH水平继续下降并趋于稳定[4]。 美国对1500多名绝经后妇女进行了评估,在25(OH)D约为30μg/L时观察到PTH水平持续下降并开始稳定。据报道,25(OH)D的血液水平为21-24μg/L的女性比> 30μg/L的女性发生继发性甲状旁腺功能亢进的可能性高3倍(图1)。Valcour等人报道年龄对血清25 (OH) D水平有独立影响,且即使PTH水平继续下降直至血清25(OH)D高达70μg/L时[6],也与之前所观察到的相似[5]。
2011年,医学研究所(IOM)在广泛的文献回顾后得出结论,为了最大限度的骨骼健康,血液中25(OH)D水平20μg/L或以上是足够的[7]。这是基于一些观察结果,包括Malabanan等人[3]和Priemel等人[8]的观察。 Priemel等人从死于事故的675名20~90岁的德国成年人采集了骨活检和血液。他们根据骨活检中广泛的未矿化类骨质缝和血液25(OH)D水平,找到了骨软化的相关证据[8]。作者得出的结论是,在这些原本被认为是健康的德国成年人中,分别有25%和35%的人存在维生素D缺乏、软化症和骨质疏松症的证据。他们进一步得出结论,当成年人血液中25(OH)D水平至少为30 μg/L时,根据骨活检没有骨软化或骨质疏松的证据,证明没有维生素D缺乏骨病。 IOM详细审核了Priemel的数据但却不正确地得出结论:25 (OH) D 血液水平21~29μg/L的研究成人中只有不到1%具有维生素D缺乏骨软化证据,而由此认为血液25 (OH) D水平20μg/L是足够的骨骼健康[7]。
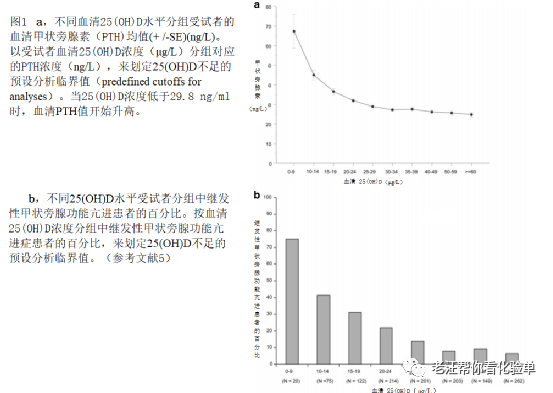
2011年,美国内分泌学会(Endocrine Society)报告了他们召集的维生素D专家小组的研究结果。在发表的《内分泌学会关于维生素D的实践指南》中,维生素D缺乏定义为25(OH)D < 20μg/L,不足定义为21~29μg/L,而充足定义为至少30μg/L,可达到最大肌肉骨骼健康。[9] 他们也认识到一些报告血清PTH水平和血清25(OH)D水平呈负相关关系的研究,其中大多数但不是所有的研究报告在25(OH)D水平接近30~40μg/L时PTH水平开始进入平台(begin to plateau)[5,6]。此外,专家小组评估了Priemel等人的数据[8]。他们意识到,当你把有软骨病证据同时血液25 (OH) D水平为21~29μg/L的假定健康成年人的数量除以血液25 (OH) D水平21~29μg/L的成年人,得到的结果不是IOM所说的不少于1%,而是德国成人被证明患有维生素D缺乏软骨病的24%[9,10]。此外,内分泌协会实践指南委员会进行了一项关于维生素D状况与跌倒的meta分析,并得出结论:血液中25(OH)D水平至少为30μg/L是降低跌倒风险的必要条件[9,11]。因此,该委员会建议,为了最大限度的肌肉骨骼健康,血清25(OH)D至少30μg/L应被认为是足够的维生素D血液水平。这个定义也被国家骨质疏松症基金会(the National Osteoporosis Foundation),国际骨质疏松症基金会(International Osteoporosis Foundation),美国临床内分泌学家协会(American Association for Clinical Endocrinologists)和美国老年病学会(the American Geriatric Society)所接受[12,13]。
2.维生素D缺乏的流行
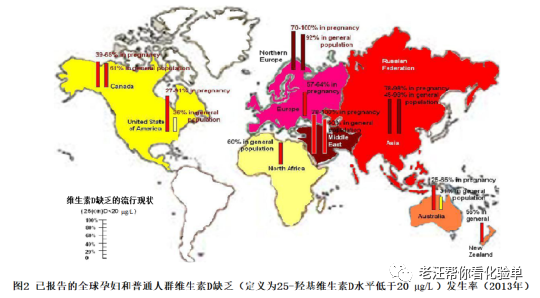
维生素D缺乏和不足是一个全球性的健康问题(图2)[12~27]。孕妇,有色人种(黑人、西班牙裔和任何皮肤黑色素增加的人),肥胖的儿童和成年人,以及避免直接晒太阳的儿童和成年人的风险特别高[9,25,27]。在波士顿进行的一项前瞻性研究对40名怀孕妇女进行了研究,她们在整个怀孕期间平均每天摄入600国际单位的维生素D(由IOM为包括孕妇在内的年龄70岁以下的所有成年人推荐维生素D的RDA),报告说,76%的母亲和81%的新生儿都缺乏维生素D,因为血液中的25(OH)D < 20μg/L[28]。孕期维生素D缺乏会增加先兆子痫、剖宫产以及子女哮喘和龋齿的风险[9,25,29 - 31]。大多数孕妇,尤其是在中国、印度、中东、中南美洲和非洲没有接受产前维生素(通常含有400~600IU的维生素D)。然而,由于每天600IU的维生素D也不足以维持血清25(OH)D超过20μg/L,这解释了世界各地的大量报告,孕妇在整个怀孕期间处于维生素D缺乏的高风险,即使她们在产前服用维生素;在一些国家报道高达100%的孕妇维生素D缺乏[25]。
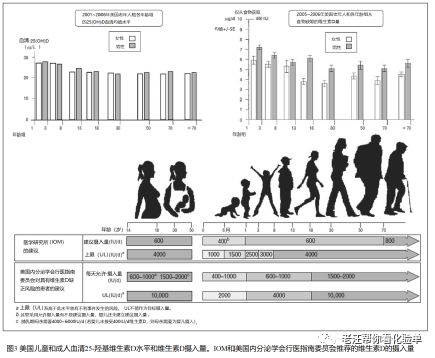
维生素D缺乏和不足在世界各地的儿童中很常见。即使在美国,牛奶、一些果汁和谷类食品都含有维生素D, 但50%的1~5岁儿童和70%的6~11岁儿童的25(OH)D < 30 μg/L[32]。(图3) 我们得出的结论是,这是由于牛奶摄入量减少、在阳光下使用防晒产品和肥胖发生率增加造成的[33]。在欧洲、中国、印度、中东和南美,维生素D缺乏和不足的发病率都很高,这些地区的食物中并没有维生素D的强化[13,15,18,23 - 26]。
据估计,全世界约有30%的儿童和60%的成人维生素D缺乏和不足[24]。即使在澳大利亚的成年人,也有31%(男性22%,女性39%)血液25(OH)D < 20μg/L, 73%低于30 μg/L[24]。
3.导致维生素D缺乏的原因
维生素D缺乏症大流行的主要原因是缺乏认识到阳光照射一直是并且仍然是大多数儿童和成人维生素D的主要来源(图4) [33-35]。天然含有维生素D的食物非常少,包括鲑鱼、鲭鱼和鲱鱼等油性鱼类、暴露在阳光下或晒干的蘑菇和鱼肝油[1,25,34]。包括牛肉和猪肉在内的肉类中含有一些,有时是大量的25(OH)D形式的维生素D[36,37]。由于在各种动物饲料中添加了25(OH)D3,许多鸡、猪和牛的肌肉中25(OH)D3的含量正在增加。生活在遥远的北纬和南纬地区的文明不仅从油性鱼类中获取维生素D,还从海豹和鲸鱼的脂肪以及北极熊的肝脏[34]中获取维生素D。阳光照射仍然是大多数儿童和成人维生素D的主要来源[33-35]。在阳光照射下7-脱氢胆固醇,胆固醇生物合成途径的直接前体,吸收紫外线B(290 ~315nm)辐照导致第9和第10号碳原子间的化学键断裂而产生前维生素D3。一旦形成这种热力学上不稳定的甾体,它的三烯系统就会发生重排,形成热力学上稳定的维生素D3。维生素D3形成后,它就会到达肝脏,在那里被转化为25(OH)D。这种代谢物随后重新进入循环,并可到达肾脏,在那里被转化为活性形式1,25-二羟基维生素D(缩写为 1,25(OH)2D)[1,25,34](图5)。
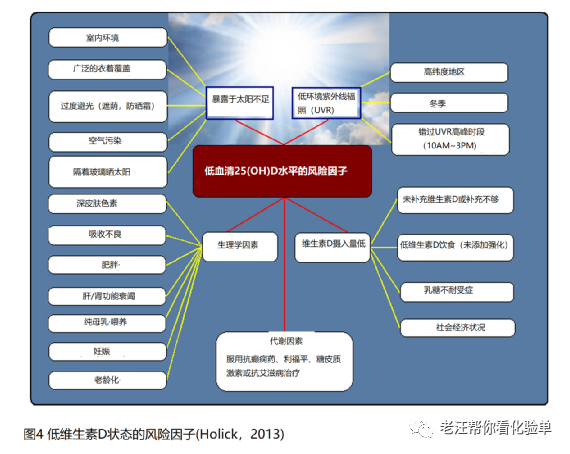
据估计,只有不超过1%的太阳总UVB辐照在夏季到达地球赤道表面[34,35,38,39]。影响太阳UVB到达地球表面多少的几个因素包括大气层一阶瑞利(first-order Rayleigh)散射、空气的衰减、氧分子和臭氧的吸收以及太阳光谱中的线结构[38-42]。大气层臭氧对UVB辐照的吸收非常有效。当天顶太阳的角度变得更倾斜时,路径长度增加,导致臭氧吸收更多的UVB辐射,从而减少到达地球表面的量[34,38 - 42]。这就能解释为什么暴露太阳大约33°角上下的冬季的并不会导致维生素D的显著生成[34,35,43]。这也解释了为什么在上午9点之前和下午3点之后,皮肤中产生的维生素D很少[34,35,39,43]。黑色素和防晒霜都能有效地吸收UVB辐射,从而降低太阳和皮肤产生维生素D的能力[34,44]。皮肤类型VI的人与皮肤类型II的人相比,需要至少5~10倍的时间暴露[44]。正确使用防晒系数(SPF)为30的防晒霜(2mg /cm2)可吸收皮肤表面97.5%的UVB辐射,从而减少97.5%的维生素D的产生[34,45]。衣服和玻璃都会吸收所有的UVB辐射,因此会阻止阳光照射下的维生素D产生[34,46,47]。
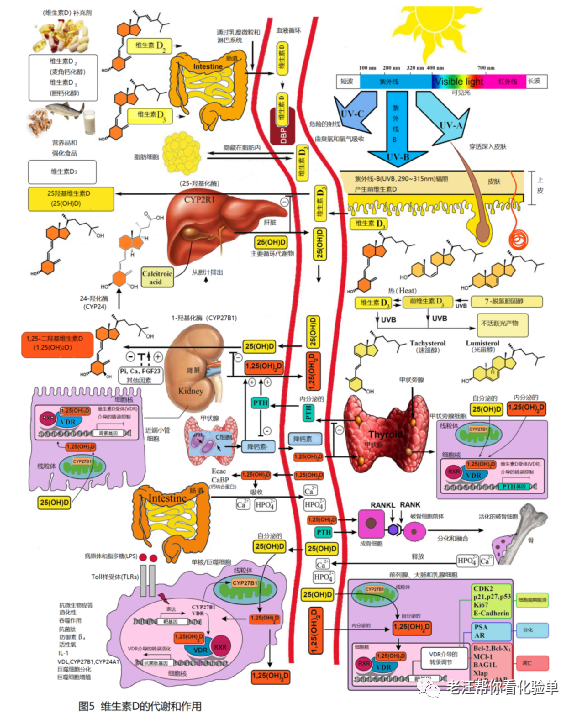
图5是维生素D的合成、代谢,及其骨骼和非骨骼功能的示意图。在阳光照射下,皮肤中的脱氢胆固醇会转化为前维生素D3。前维生素D3通过热依赖性过程立即转化为维生素D3。过度暴露在阳光下会将前维生素D3和维生素D3降解为无活性的光产物。来自食物的维生素D2和维生素D3被吸收到乳糜微粒中,通过淋巴系统输送到静脉循环。皮肤或饮食中摄入的维生素D (D代表D2或D3)可以储存在脂肪细胞中,然后从脂肪细胞中释放出来。循环中的维生素D与维生素D结合蛋白(DBP)结合,DBP将维生素D运输到肝脏,在肝脏中维生素D被维生素D-25-羟化酶转化为25(OH)D。这是临床医生用来测量维生素D状态的主要循环形式(虽然大多数参考实验室报告的正常范围是20~100 μg/L,但健康的推荐范围是30~60 μg/L)。它没有生物活性,必须在肾脏等组织中经25-羟基维生素D-1α-羟化酶(1- 羟化酶)催化转化为具有生物活性的1,25(OH)2D。1,25(OH)2D然后被靶细胞吸收,并靶向结合细胞内D结合蛋白(IDBP)到线粒体24-羟化酶或维生素D受体(VDR)。1,25(OH)2D-VDR复合物与维甲酸受体(RXR)异二聚并结合到目标基因启动子区域的特定序列。DNA结合的异源二聚体吸引RNA聚合酶II复合体和核转录调节因子的成分。血清磷、成纤维细胞生长因子(FGF-23)钙等因子可增加或减少肾脏1,25(OH)2D的生成。1,25(OH)2D反馈调节自身合成,减少甲状旁腺中甲状旁腺激素(PTH)的合成和分泌。1,25(OH)2D增强25-羟基维生素D-24-羟化酶(24-羟化酶)的表达,将1,25(OH)2D分解为水溶性的、无生物活性的钙化酸(calcitroic acid),并在胆汁中排泄。1,25(OH)2D通过刺激上皮钙通道(ECaC)和钙结合蛋白(CaBP,calbindin 9 K )的表达,增强小肠钙吸收。1,25(OH)2D在成骨细胞中被其受体识别,导致NF-kB配体(RANKL)的受体激活因子表达增加。其在破骨细胞上的受体RANK与RANKL结合,诱导破骨细胞成为成熟的破骨细胞。成熟的破骨细胞从骨头中去除钙和磷,以维持血液中的钙和磷水平。而机体充足的钙和磷水平则促进骨骼矿化。25(OH)D的自分泌代谢:当巨噬细胞或单核细胞通过toll样受体2/1 (TLR2/1)被感染因子如结核分枝杆菌或其脂多糖刺激时,该信号上调VDR和1-羟化酶的表达。30μg/L或更高的25(OH)D水平为1- 羟化酶提供了足够的底物,将线粒体中的25(OH)D转化为1,25(OH)2D。1,25(OH)2D到达细胞核,在那里它增加了抗菌肽的表达,这是一种能够促进先天免疫和诱导破坏感染性病原体如结核分枝杆菌的肽。也有可能单核细胞或巨噬细胞中产生的1,25(OH)2D被释放出来,局部作用于调节细胞因子合成的活化T淋巴细胞和调节免疫球蛋白合成的活化B淋巴细胞。当25(OH)D水平约为30 μg/L时,许多常见癌症的风险就会降低。据认为,乳腺、结肠、前列腺等组织中1,25(OH)2D的局部生成调节了多种控制增殖的基因,包括p21和p27,以及抑制血管生成、诱导分化和凋亡的基因。一旦1,25(OH)2D完成维持正常细胞增殖和分化的任务,它就会诱导24-羟化酶的表达,从而增强1,25(OH)2D向无生物活性的钙化酸的分解代谢。因此,局部产生的(自分泌) 1,25(OH)2D不进入循环,对钙代谢没有影响。甲状旁腺具有1- 羟化酶活性,局部产生1,25(OH)2D抑制PTH的表达和合成。在肾脏中产生的1,25(OH)2D进入循环,可下调肾脏中肾素的产生,刺激胰岛细胞中胰岛素的分泌。
4.治疗和预防维生素D缺乏和不足
维生素D有两种形式。维生素D3(胆钙化醇)在阳光照射下的皮肤中产生,也存在于油性鱼类和鱼肝油中[1,25,34]。(图5) 补充剂中的维生素D3从鱼油提取或由胆固醇(来自于羊毛中的羊毛脂)人工合成。商业生产的维生素D2(麦角钙化醇)经由紫外辐照酵母产生,它也存在于暴露于阳光或紫外线B辐照下的蘑菇和晒干的蘑菇中[48]。维生素D2用于治疗和预防维生素D缺乏已有50多年的历史[1,25,34]。它也被用来强化一些食品,比如在牛奶中加入维生素D。然而,一些报道提出了这样的问题:维生素D2在维持25(OH)D水平方面是否与维生素D3同样有效[49-53]。一项研究报告说,维生素D2增加了对维生素D3的破坏,提示摄入维生素D2会使患者更快患上维生素D缺乏[51]。因此维生素D2单次给药可能是正确的,而长期服用就不正确了。另有几项研究评估了维生素D2和维生素D3的生理剂量(1000IU或2000IU)对于血液中25(OH)D总水平的影响[48,54,55]。这些研究报告称,摄入1000IU的维生素D2不仅使血液中的25(OH)D水平提高到与摄入1000IU的维生素D3相同的水平,而且25(OH)D3没有明显下降。有研究评估了5万IU的维生素D2每2周治疗和预防复发性维生素D缺乏长达6年的时间,证明了该方法对维持总25(OH)D水平高于30μg/L有效[56]。可以肯定地说,25(OH)D2在肾脏中转化为1,25(OH)2D2的效率与25(OH)D3一样。一项研究分析了接受1000IU的维生素D2或维生素D3的成年人血清样本中1,25(OH)2D2和1,25(OH)2D3含量。正如预期的那样,当向肾脏提供25(OH)D2时,它非常显著地将其转化为1,25 (OH)2D2。由于1,25(OH)2D2增加导致的1,25(OH)2D3等量减少,使总1,25(OH)2D与基线没有变化[55]。这是意料之中的,因为1,25(OH)2D的血液水平受到PTH和其他因素的严格调控[1,25]。在美国,只有维生素D2是药物,因为它早在美国食品和药物管理局(FDA)之前就已经作为一种药物存在了。维生素D3从未被认为是药物,但作为补充剂被广泛使用。美国的问题是药房可以从不同的制造商那里获得这种补充剂,我们不知道这种补充剂的质量,但我们知道药物维生素D2的质量。国内知名品牌生产的维生素D3补充剂完全没问题。我已经测试并证明许多著名的国家品牌其维生素D3含量恰如标签所述。对于那些希望服用维生素D补充剂的患者,我建议他们服用国内品牌的维生素D3。而若为素食主义者,我建议他们服用维生素D2。
有人认为大多数研究都使用维生素D3来证明骨折的疗效所以为什么我们要使用维生素D2来治疗维生素D缺乏的患者。基于所有的证据,没有理由怀疑维生素D2不会像维生素D3一样对骨折有同样的好处,因为维生素D2和维生素D3在钙代谢方面有相同的生物学功能。也有人认为,维生素D2没有任何其他健康益处,如降低死亡率和恶性肿瘤的风险[57]。然而,这些结论主要是基于关于维生素D2摄入量的研究的荟萃分析,而不是专门比较维生素D2和维生素D3的研究。此外,这些研究大多没有报道血液中25(OH)D2的水平。有证据表明25(OH)D2的半衰期比25(OH)D3短。[58] 可能表明维生素D2的效果不如维生素D3的生物作用。然而其中一个原因是25(OH)D2的半衰期较短,这是因为它与DBP的结合不像25(OH)D3那么紧密[58]。这表明游离25 (OH) D2水平会比游离25 (OH) D3更高。从理论上讲,游离水平被认为最具生理的好处,或许可望维生素D2会比维生素D3在生物学上更有效。Chun等人[58]的观察结果支持了这一假设。他们评估了膳食维生素D2与膳食维生素D3对C56BL/6小鼠25(OH)D游离总水平的影响,并在16周时通过组织形态测定法评估了这些水平对骨形态的影响。摄入维生素D2(33.3±4.4μg/L)和摄入维生素D3(31.7±2.1μg/L)的小鼠的25(OH)D总量基本相同,这与临床观察结果一致[54,55,58]。然而,持续16周后,服用维生素D2 (17.4 ng/L)的老鼠体内的游离25(OH)D含量几乎是服用维生素D3 (8.4 ng/L)的老鼠的两倍。这转化为一个积极的好处,因为实验证明,与摄入相同数量维生素D3的小鼠相比,摄入维生素D2的小鼠的骨体积/总体积和小梁数量显著更高。这项研究有助于支持这样一种观点,即至少在骨骼健康方面,补充维生素D2与补充维生素D3一样有效,甚至可能更有效。所有这些观察结果都表明,维生素D2至少比补充维生素D3更有益,并且应该消除人们不愿意使用维生素D2来治疗和预防维生素D缺乏的科学依据。
由于维生素D2是一种药物,而且仅以50,000IU的胶囊形式提供,因此对其治疗和预防成人维生素D缺乏症进行了评估。每周给予50,000IU的维生素D2,持续8周,是治疗维生素D缺乏的有效策略[3,56]。有人建议,血液中25(OH)D含量检测不出来的患者应该接受更长时间的维生素D治疗。虽然这看起来像是很好的常识,但事实证明并非如此。原因是肝脏中至少有4种不同的25-羟化酶,其中一些能有效地将少量维生素D迅速转化为25(OH)D。这就是为什么给予每天摄入维生素D600-800IU会迅速将血液中的25(OH)D提高到15~20μg/L[9,59]。然而,一个正常体重的人一旦血液中25(OH)D水平达到大约20μg/L后,再要每提高约0.6-1 μg/L就需要增加补充100IU的维生素D [9,54-56, 60]。这也解释了为什么给一个血液25(OH)D水平约为18~20μg/L的成年人每天补充1000IU维生素D却不能有效地将血液25(OH)D水平提高到30μg/L以上[54]。
为了防止再次出现维生素D缺乏症,认识到患者维生素D缺乏症的原因是很重要的,因为他或她没有通过饮食或阳光中获得足够的维生素D。为了防止复发,给50000IU(1.25mg)每两周服用一次的维生素D2不仅有效,而且至少可以安全服用6年[56,61]。另一种治疗维生素D缺乏症的方法是每天5000IU,持续2个月然后每天维持2000到3000IU的维生素D2或维生素D3。为了达到40~60 μg/L的血液水平,需要每天服用4000-5000IU的维生素D2或维生素D3[60,62]。在怀孕期间,每天服用4000IU维生素D3的孕妇维持了大约50 μg/L25(OH)D水平,没有证据表明有毒性,因为她们的尿和血清钙水平没有变化[63]。BMI >30的肥胖成年人需要2~3倍以上的维生素D来治疗和预防维生素D缺乏[9,64,65]。这是因为维生素D是脂溶性的,会在体内脂肪中被稀释,不能生物利用。患有炎症性肠病和胃旁路手术的患者吸收脂溶性维生素D的效率较低,通常需要更高的剂量来治疗和预防维生素D缺乏。在某些情况下,由于维生素D不能被胃肠道吸收,就需要暴露于阳光或人工阳光(例如UVB灯,如Sperti灯或发出UVB辐射的晒黑床),这是治疗和预防维生素D缺乏症的有效替代法[34,35,66 - 68]。
新生儿出生后应尽快每天摄入400IU的维生素D,尤其是母乳喂养的婴儿,因为人母乳中维生素含量非常少,除非母亲每天摄入大约6400IU的维生素D[9,69]。为了快速纠正婴儿维生素D缺乏,婴儿可以每天服用2000IU的维生素D 连续6-8周[9,70]。对于那些他们担心可能不会有机会进行复诊的婴儿,他们可以接受Stoss治疗,这是一种非常高的剂量,通常是250000 IU的维生素D肌肉注射,以预防婴儿佝偻病[71,72]。缺乏维生素D的幼儿和儿童可以每周服用50,000IU的维生素D,持续6周或每天服用2000IU的维生素D,不考虑毒性[9,70]。
一些医疗保健专业人员会提供活性维生素D,即1,25(OH)2D3(骨化三醇)或其活性类似物1-α-羟基维生素D3(即所谓的“阿尔法D3”,译者注),认为给予这些类似物是治疗维生素D缺乏症的有效方法。然而,这些类似物不仅半衰期相对较短,而且会引起高钙尿和高钙血症,不应用于治疗维生素D缺乏症。然而,这些活性形式的维生素D对治疗先天或后天的25(OH)D转化为1,25(OH)2D代谢紊乱的患者(特别是严重慢性肾病患者)是有效的[1]。
5.维生素D毒性
维生素D中毒极为罕见。一个人不能因为晒太阳而发生维生素D中毒,因为过量的维生素D也会被太阳光破坏[34]。唯一的原因是由于无意或有意地长期摄入过量的维生素D。[73 - 76] 例如误解了微克和毫克之间的差异,制造商添加了比标签上多1000倍的维生素D,血清磷酸盐水平在50~60 mg/L范围内(正常范围为27~45 mg/L)。他们的血25(OH)D水平在350~550 μg/L[75]。
6.关于血25(OH)D水平的J曲线和U曲线的担忧
IOM在其报告中提出了对血液25(OH)D水平高于50 μg/L的担忧[7]。IOM小组成员一致认为,维生素D缺乏与死亡风险增加有关,特别是心血管疾病。IOM小组成员绘制了一些研究报告的死亡率与血液25 (OH) D水平的关系。发现当血清25(OH)D水平接近30μg/L时,他们的死亡率显著下降,然后在50 μg/L时出现轻微上升。IOM小组成员得出的结论是,如果血液中25(OH)D的水平高于50 μg/L,应该担心潜在的死亡风险增加。这就是所谓的J曲线或U曲线效应。然而,他们绘制的一项研究实际上得出结论,男性高于50μg/L的死亡率风险继续下降,而只有女性的死亡率风险可能有轻微增加[77]。一些出版物似乎对所谓的J- U曲线的概念提出了挑战。[78,79]首先,在任何研究中,这些受试者中很少有血清浓度高于50 μg/L。然而,更重要的问题是从未被问及的是,为什么在这些研究中,有一些人的血中25(OH)D的水平高于50 μg/L。一种可能的解释是,这些人实际上是维生素D缺乏并正在接受维生素D缺乏治疗。为了证实这种可能性,Kroll等人[79]报道了两年时间内在美国收集的380万份成人血样。由于维生素D2是治疗维生素D缺乏症的常规药物,因此样品通过液相色谱串联质谱分析是否存在25(OH)D2。在总25(OH)D为50 μg/L或更高的样本中,明显有57%的样本检测到25(OH)D2。这表明这些人正在接受维生素D缺乏治疗,因此更有可能由于他们之前的慢性维生素D缺乏而面临更高的死亡风险[79]。
7.结论
关于什么水平的血液25(OH)D可认为是维生素D缺乏或充足,一直存在争议[7,9,10,79 81]。它部分是基于维生素D缺乏的定义,即需要多少维生素D才能达到维生素D足够。IOM采用人群模型,并确定对于1岁内的新生儿、儿童和70岁以下的成人,以及70岁以上成人,分别只需要每天400、600和800IU就足以使其中97.5%的人群的血清25 (OH) D达到 20 μg/L[7]。IOM的建议并不打算为维生素D缺乏症的治疗和预防提供指导。这些建议是由专业协会提出的。美国内分泌学会、国家和国际骨质疏松基金会(National and International Osteoporosis Foundations)和美国老年学会(the American Geriatric Society)选择将维生素D充足定义为血液中25(OH)D水平至少为30 μg/L[9,12]。他们还认为其血液浓度达到100 μg/L是非常安全的。内分泌学会推荐的其首选范围为40 ~ 60 μg/L。这可能是我们的祖先每天暴露在阳光下的狩猎采集所达到的范围。人体有巨大的能力产生维生素D。半个成年人暴露在约50%的阳光下,24小时后会造成轻度晒伤,相当于每天摄入约5000IU的维生素D[33,35]。这与马赛牧民的观察结果一致,他们的血液中25(OH)D的水平为40~50 μg/L[82]。要达到并维持这一水平,成人每天需要摄入4000~5000IU的维生素D[60,62]。因此,内分泌学会建议1岁以下儿童、1岁~18岁儿童和所有成年人每日的维生素D摄取量分别为400~1000IU、600 ~1000IU和1500 ~2000IU,由此来治疗和预防维生素D缺乏是合理的[9]。然而,青少年应该像成年人一样对待,每天至少摄入1500~2000IU[83]。IOM所建议大多数儿童和成人的上限为每天4000IU。美国内分泌学会赞成每天4000IU是儿童的合理上限,但成人的上限为每天10000IU更合理,特别是肥胖人群需要2~3倍以上的维生素D来治疗和预防复发的维生素D缺乏[9,62]。
有众多有关维生素D对健康的好处和日晒降低许多慢性病风险的研究,这些慢性病包括致命的癌症、自身免疫病(多发性硬化症、风湿性关节炎、克罗恩病和1型糖尿病疾病)、心血管疾病、神经认知功能障碍、2型糖尿病和传染病[1, 25, 34, 35, 84, 85]。
许多皮肤病协会提出在没有防晒保护的情况下避免一切直接阳光照射[86]并没有显著降低最致命的皮肤癌——黑色素瘤的发病率[87]。这是意料之中的,因为大多数黑色素瘤发生在阳光暴露最少的地方,而职业性日光照射减少会降低黑色素瘤的风险[88,89]。此外,肥胖与黑色素瘤及非黑色素瘤皮肤癌的风险增加有关[87]。过度晒伤不仅会增加致命黑色素瘤的风险,也会增加非黑色素瘤皮肤癌的风险[88,89]。Felton等人报道说,居住在英国的II型皮肤患者,暴露在预计将在夏季接受的紫外线辐射下,如预期的那样,表皮的DNA损伤增加。这种暴露也显著提高了他们血液中的25(OH)D水平[90]。在研究结束时对表皮的评估显示DNA损伤明显减少了(通过尿液中DNA代谢物减少反映出来)。这证明了II型皮肤的白种人在赤道北部和南部迁移中其进化不仅允许更有效地生产维生素D,同时在暴露维生素D-UVB太阳辐射中发展出克服DNA损伤机制[91]。最近,世界卫生组织在其网站上承认,合理的阳光确实对健康有益,包括产生维生素D。然而,很难确定合理的日照量,因为白天的时间、季节、纬度、海拔和皮肤色素沉着都会显著影响暴露在阳光下皮肤产生的维生素D量[34,35]。为此,有人为安卓和苹果手机开发了免费应用软件(APP)“dminder.info”,专为用户提供一年内地球上任何地方任何时候的所有皮肤类型在阳光照射下能产生多少维生素D的信息[91]。它还建议用户在暴露于足够阳光下时寻求防晒措施,以免晒伤。越来越多的证据表明,充足的维生素D对健康有各种各样的好处,而改善每个人的维生素D状况并没有任何坏处。目标应该是血液中25(OH)D的水平至少为30 μg/L;首选范围为40~60μg/L。这可以通过增加每个人的维生素D补充来达到内分泌学会推荐的水平[9],以及获得敏感的阳光照射来实现[34,90 - 94]。没有必要对每个人进行维生素D筛查[7,9]。在食物中增加维生素D含量[34,9093,95,96],并鼓励补充维生素D和适当的阳光照射,是更经济有效的方法。然而,那些有脂肪吸收不良综合征的人,那些做过胃分流手术或有其他危险因素或先天或后天维生素D代谢障碍的人,确实需要筛查并随访测定25(OH)D[1,9,62]。
遵守道德标准:本文系综述,不存在合规和道德标准方面的问题。
利益冲突:作者宣称自己是Quest顾问,目前为赛诺菲公司(Sanofi Inc.)发言人办公室成员。
参考文献
1. Holick MF. Vitamin D deficiency. New Engl J Med. 2007;357: 266–8.
2. Chapuy MC, Schott AM, Garnero P, Hans D, Delmas PD, Meunier J, et al. Healthy elderly French women living at home have secondary hyperparathyroidism and high bone turnover in winter. J Clin Endocrinol Metab. 1996;81:1129–33.
3. Malabanan A, Veronikis IE, Holick MF. Redefining vitamin D insufficiency. Lancet. 1998;351:805–6.
4. Thomas KK, Lloyd-Jones DH, Thadhani RI, Shaw AC, Deraska DJ, Kitch BT, Vamvakas EC, Dick IM, Prince RL,Finkelstein JS. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998;338: 777–83.
5. Holick MF, Siris ES, Binkley N, Beard MK, Khan A, Katzer JT, Petruschke RA. Chen E and de Papp prevalence of vitamin D inadequacy among postmenopausal north American women receiving osteoporosis therapy. J Clin Endocrinol Metab. 2005;90(6): 3215–24.
6. Valcour A, Blocki F, Hawkins DM, Rao SD. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab. 2012;97(11):3989–95.
7. IOM (Institute of Medicine) Dietary reference intakes for calcium and vitamin D. Committee to Review Dietary Reference Intakes for Calcium and Vitamin D Washington DC: The National Academies Press Institute of Medicine 2011.
8. Priemel M, von Domarus C, Klatte TO, Kessler S, Schlie J, Meier S, Proksch N, Pastor F, Netter C, Streichert T, Puschel K, Amling M. Bone mineralization defects and vitamin D deficiency: Histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J Bone Miner Res. 2010;25(2):305–12.
9. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, Murad MH, Weaver CM. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911– 30.
10. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, Murad MH, Weaver CM. Controversy in clinical Endocrinology: guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J Clin Endocrinol Metab. 2012;97:1153–8.
11. Murad MH, Elamin KB, AbuElnour NO, Elamin MB, Alkatib AA, Fatourechi MM, Almandoz JP, Mullan RJ, Lane MA, Liu H, Erwin PJ, Hensrud DD, Montori VM. Interventions to raise vitamin D level and functional outcomes: a systematic review and
metaanalysis. J Clin Endocrinol Metab. 2011;96(7):1911–30.
12. American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults. Recommendations abstracted
from the American Geriatrics Society Consensus Statement on vitamin D for Prevention of Falls and Their Consequences. J Am
Geriatr Soc. 2014;62:147.
13. Fischer PR, Thacher TD, Pettifor JM. Pediatric vitamin D and calcium nutrition in developing countries. Rev Endocr Metab Disord. 2008;9(3):181–92.
14. Merewood A, Mehta SD, Grossman X, Chen TC, Mathieu JS,Holick MF, et al. Widespread vitamin D deficiency in urban
Massachusetts newborns and their mothers. Pediatr. 2010;125:640–7. 416
15. Zhu Z, Zhan J, Shao J, et al. High prevalence of vitamin D deficiency among children aged 1 month to 16 years in Hangzhou,
China. BMC Public Health. 2012;12:126.
16. Sacheck J, Goodman E, Chui K, et al. Vitamin D deficiency, adiposity, and cardiometabolic risk in urban schoolchildren. J Pediatr. 2011;159:945–50.
17. Shivane VK, Sarathi V, Bandgar T, et al. High prevalence of hypovitaminosis D in young healthy adults from the western part of India. Postgrad Med J. 2011;87:514–8.
18. van Schoor NM, Lips P. Worldwide vitamin D status. Best Pract Res Clin Endocrinol Metab. 2011;25(4):671–80.
19. Fields J, Trivedi NJ, Horton E, Mechanick JI. Vitamin D in the Persian Gulf: integrative physiology and socioeconomic factors. Curr Osteoporos Rep. 2011;9:243–50.
20. Ganji V, Zhang X, Tangpricha V. Serum 25-hydroxyvitamin D concentrations and prevalence estimates of hypovitaminosis D in the U.S. population based on assay adjusted data. J Nutr. 2012;142(3): 498–507.
21. Zhang R, Naughton DP. Vitamin D in health and disease: current perspectives. Nutr J. 2010;9:65.
22. Greene-Finestone LS, Berger C, de Groh M, et al. 25- Hydroxyvitamin D in Canadian adults: biological, environmental,
and behavioral correlates. Osteoporos Int. 2011;22:1389–99.
23. González-Gross M, Valtueña J, Breidenassel C, et al. Vitamin D status among adolescents in Europe: the healthy lifestyle in Europe by nutrition in adolescence study. Br J Nutr. 2012;107(5):755–64.
24. Daly RM, Gagnon C, Lu ZX, et al. Prevalence of vitamin D deficiency and its determinants in Australian adults aged 25 years and older: a national, population-based study. Clin Endocrinol. 2012;77:26–35.
25. Hossein-nezhad A, Holick MF. Vitamin D for health: a global perspective. Mayo Clin Proc. 2013;88(7):720–55.
26. Pludowski P, Holick MF, Pilz S, Wagner CL, Hollis BW, Grant WB, Shoenfeld Y, Lerchbaum E, Llewellyn DJ, Kienreich K, Soni M. Vitamin D effects on musculoskeletal health, immunity, cardiovascular disease, cancer, fertility, pregnancy, dementia and mortality – a review of recent evidence. Autoimmun Rev. 2013;12:976–89.
27. Nesby-O'Dell S, Scanlon KS, Cogswell ME, Gillespie C, Hollis BW, Looker AC. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: third national health and nutrition examination survey, 1988-1994. Am J Clin Nutr. 2002;76:187–92.
28. Lee JM, Smith JR, Philipp BL, Chen TC, Mathieu J, Holick MF. Vitamin D deficiency in a healthy group of mothers and newborn infants. Clin Pediatr. 2007;46:42–4.
29. Camargo CA Jr, Rifas-Shiman SL, Litonjua AA, et al. Maternal intake of vitamin D during pregnancy and risk of recurrent wheeze in children at 3 y of age. Am J Clin Nutr. 2007;85(3):788–95.
30. Merewood A, Mehta SD, Chen TC, Holick MF, Bauchner H. Association between severe vitamin D deficiency and primary caesarean section. J Clin Endocrinol Metab. 2009;94(3):940–5.
31. Ullah MI, Koch CA, Tamanna S, Rouf S. Shamsuddin. Vitamin D deficiency and the risk of preeclampsia and eclampsia in
Bangladesh. Horm Metab Res. 2013;45(9):682–7.
32. Kumar J, Muntner P, Kaskel FJ, Hailpern SM. Prevalence and associations of 25-hydroxyvitamin D deficiency in US children: NHANES 2001-2004. Pediatrics. 2009;124(3):e362–70.
33. Looker AC, Johnson CL, Lachner DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011;56
34. Wacker M, Holick MF. Sunlight and vitamin D: a global perspective for health. Dermato-Endocrinol. 2013;5(1):51–108.
35. Holick MF. Biologic effects of sunlight, ultraviolet radiation, visible light, infrared, and vitamin D for health. Anticancer. 2016;36:1345– 56.
36. Heaney R, Armas LAG, French C. All-sources: basal vitamin D inputs are greater than previously thought and cutaneous inputs are smaller. J Nutr. 2013;143:571–5.
37. Crowe FL, Steur M, Allen NE, Appleby PN, Travis RC, Key TJ. Plasma concentrations of 25-hydroxyvitamin D in meat eaters, fish eaters, vegetarians and vegans: results from the EPIC-Oxford study. Public Health Nutr. 2011;14(2):340–6.
38. Manicourt DH, Devogelaer JP. Urban tropospheric ozone increases the prevalence of vitamin D deficiency among Belgian postmenopausal women with outdoor activities during summer. J Clin Endocrinol Metab. 2008;93(10):3893–9.
39. Moan J, Dahlback A, Porojnicu AC. At what time should one go out in the sun? Adv Exp Med Biol. 2008;624:86–8.
40. Seckmeyer G, Glandorf M, Wichers C, McKenzie R, Henriques D, Carvalho F, Webb A, Siani AM, Bais A, Kjeldstad B, Brogniez C, Werle P, Koskela T, Lakkala K, Gröbner J, Slaper H, denOuter P, Feister U. Europe's darker atmosphere in the UV-B. Photochem Photobiol Sci 2008, 7(8):925–30.
41. Brogniez C, Werle P, Koskela T, Lakkala K, Gröbner J, Slaper H, denOuter P, Feister U. Europe's darker atmosphere in the UV-B. Photochem Photobiol Sci. 2008;7(8):925–30.
42. Brinkmann RT, Green AE, Barth CA. Atmospheric scattering of the solar flux in the middle ultraviolet. Appl Opt. 1967;6(3):373–83. doi:10.1364/AO.6.000373.
43. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab. 1988; 67:373–8.
44. Clemens TL, Henderson SL, Adams JS, Holick MF. Increased skin pigment reduces the capacity of skin to synthesis vitamin D3. Lancet. 1982;1(8263):74–6.
45. Matsuoka LY, Ide L, Wortsman J, MacLaughlin JA, Holick MF. Sunscreens suppress cutaneous vitamin D3 synthesis. J Clin
Endocrinol Metab. 1987;64:1165–8.
46. Matsuoka LY, Wortsman J, Hanifan N, Holick MF. Chronic sunscreen use decreases circulating concentrations of 25-
hydroxyvitamin D. A preliminary study. Arch Dermatol. 1988;124:1802–4.
47. Godar DE, Pope SJ, Grant WB, Holick MF. Solar UV doses of adult and vitamin D3 production. Dermato-Endocrinol. 2011;3(4): 1–8. 437
48. Keegan RJ, Lu Z, Bogusz JM, Williams JE, Holick MF. Photobiology of vitamin D in mushrooms and its bioavailability
in humans. Dermato-Endocrinol. 2013;5(1):165–76.
49. Tang HM, Cole DEC, Rubin LA, Pierratos A, Siu S, Vieth R. Evidence that vitamin D3 increases serum 25-hydroxyvitamin D more efficiently than does vitamin D2. Am J Clin Nutr. 1998;68: 854–8.
50. Heaney RP, Recker RR, Grote J, Horst RL, Armas LAG. Vitamin D3 is more potent than vitamin D2 in humans. J Clin Endocrinol Metab. 2011;152(2):741.
51. Armas LA, Hollis BW, Heaney RP. Vitamin D2 is much less effective than vitamin D3 in humans. J Clin Endocrinol Metab.
2004;89(11):5387–91.
52. Heaney RP, Recker RR, Grote J, Horst RL, Armas LA. Vitamin D(3) is more potent than vitamin D(2) in humans. J Clin Endocrinol Metab. 2011;96(3):E447–52.
53. Oliveri B, Mastaglia SR, Brito GM, Seijo M, Keller GA, Somoza J, Diez RA, Di Girolamo G. Vitamin D3 seems more appropriate than D2 to sustain adequate levels of 25OHD: a pharmacokinetic approach. Eur J Clin Nutr. 2015;69(6):697–702.
54. Biancuzzo RM, Cai MH, Winter MR, Klein EK, Ameri A, Reitz R, Salameh W, Young A, Bibuld D, Chen TC, Holick MF.
Fortification of orange juice with vitamin D2 or vitamin D3 is as effective as an oral supplement in maintaining vitamin D status in adults. Am J Clin Nutr. 2010;91:1621–6.
55. Biancuzzo RM, Clarke N, Reitz RE, Travison TG, Holick MF. Serum concentrations of 1,25-dihydroxyvitamin D2 and 1,25-
dihydroxyvitamin D3 in response to vitamin D2 and vitamin D3 supplementation. J Clin Endocrinol Metab. 2013;98(3):973–9.
56. Pietras SM, Obayan BK, Cai MH, Holick MF. Vitamin D2 treatment for vitamin D deficiency and insufficiency for up to 6 years. Arch Intern Med. 2009;169:1806–8.
57. Chowdhury R, Kunutsor S, Vitezova A, Oliver-Williams C, Chowdhury S, Kiefte-de-Jong JC, Khan H, Baena CP, Prabhakaran D, Hoshen MB, Feldman BS, Pan A, Johnson L, Crowe F, Hu FB, Franco OH. Vitamin D and risk of cause specific
death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ. 2014;348:g1903.
58. Chun RF, Hernandez I, Pereira R, Swin Differential responses to vitamin D2 and vitamin D3 are associated
kles L, Huijs T, Zhou R, Liu NQ, Shieh A, Guemes M, Mallya SM, Adams JS, Hewison M. with variations in free 25-hydroxyvitamin D. Endocrinology. 2016;157:3420–30.
59. Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. Am J Clin Nutr. 2008;87(4):1080S–6S.
60. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ.Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77:204–10.
61. Demetriou ETW, Travison TG, Holick MF. Treatment with 50,000 IU vitamin D2 every other week and effect on Serum 25-
hydroxyvitamin D2, 25-hydroxyvitamin D3 and total 25- hydroxyvitamin D in a clinical setting. Endocr Prac. 2012;18(3):
399–402.
62. Ekwaru JP, Zwicker JD, Holick MF, Giovannucci E, Veugelers PJ. The importance of body weight for the dose response relationship of oral vitamin D supplementation and serum 25-hydroxyvitamin D in healthy volunteers. PLoS One. 2014; doi:10.1371/journal.pone. 0111265. 520.
63. Hollis BW, Johnson D, Hulsey TC, Ebeling M. Wagner. Vitamin D supplementation during pregnancy: double-blind, randomized clinical trial of safety and effectiveness. J Bone Miner Res. 2011;26(10):2341–57. doi:10.1002/jbmr.463.
64. Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr. 2000;72: 690–3.
65. Boonchaya-anant P, Holick MF, Apovian CM. Serum 25- hydroxyvitamin D levels and metabolic health status in extremely
obese individuals. Obes J. 2014;22(12):2539–43. doi:10.1002/oby. 20877. 516.
66. Dabai NS, Pramyothin P, Holick MF. The effect of ultraviolet radiation from a novel portable flourescent lamp on serum 25-
hydroxyvitamin D3 Levels in healthy adults with Fitzpatrick skin types II and III. Photodermatol Photoimmunol Photomed.
2012;28(6):307–11. 474
67. Koutkia P, Lu Z, Chen TC, Holick MF. Treatment of vitamin D deficiency due to Crohn's disease with tanning bed ultraviolet B radiation. Gastroenterol. 2001;121:1485–8.
68. Chandra P, Wolfenden LL, Ziegler TR, Tian J, Luo M, Stecenkoo AA, Chen TC, Holick MF, Tangpricha V. Treatment of vitamin D deficiency with UV light in patients with malabsorption syndromes: a case series. Phtodermatol Photoimunol Photmed. 2007;23(5): 179–85.
69. Hollis BW, Wagner CL, Howard CR, Ebeling M, Shary JR, Smith PG, Taylor SN, Morella K, Lawrence RA, Hulsey TC. Maternal versus infant vitamin D supplementation during lactation: a randomized controlled trial. Pediatrics. 2015;136:625–34.
70. Gordon CM, Williams AL, Feldman HA, May J, Sinclair L, Vasquez A, Cox JE. Treatment of hypovitaminosis D in infants
and toddlers. J Clin Endocrinol Metab. 2008;93(7):2716–21.
71. Holick MF. Case 3-2009: a 9-month-old boy with seizures. New Eng J Med CPC. 2009;360(4):398–407.
72. Holick MF. Vitamin D is not as toxic as was once thought: A historical and an up-to-date perspective. 2015 May. Mayo Clin
Proc. 90(5):561–4. 530
73. Araki T, Holick MF, Alfonso BD, Charlap E, Romero CM, Rizk D,Newman LG. Vitamin D intoxication with severe hypercalcemia due to manufacturing and labelling errors for two dietary supplements made in the United States. J Clin Endocrinol Metab. 2011;96(12):3603–8. 451
74. Koutkia P, Chen TC, Holick MF. Vitamin D intoxication associated with an over-the-counter supplement. N Engl J
Med. 2001;345(1):66–7.
75. Jacobus, C.H., Holick, M.F., Shao, Q., Chen, T.C., Holm I.A., Kolodny, J.M., El-Hajj Ful eihan, G. and Seely, E.
Hypervitaminosis D associated with drinking milk. N Engl J Med. 1992. 326(18):1173–1177. 120.
76. Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr. 1999, 69(5):842–856.
77. Melamed ML, Michos ED, Post W, Astor B. 25-Hydroxyvitamin D .levels and the risk of mortality in the general population. Arch Intern Med. 2008;168(15):1629–37.
78. Grant WB, Karras SN, Bischoff-Ferrari HA, Annweiler C, Boucher BJ, Juzeniene A, Garland CF, Holick MF. Do studies reporting 'U'- shaped serum 25-hydroxyvitamin D-health outcome relationships reflect adverse effects? Dermato-Endocrinology. 2016;8(1): e1187349.
79. Kroll MH, Bi C, Garber CC, et al. Temporal relationship between vitamin D status and parathyroid hormone in the United States. PLoS One. 2015;10(3):e 0118108. doi:10.1371/journal.pone.0118108.eCollection 2015.
80. Rosen CJ, Abrams SA, Aloia JF, Brannon PM, Clinton SK, Durazo-Arvizu RA, Gallagher JC, Gallo RL, Jones G, Kovacs
CS, Manson JE, Mayne ST, Ross AC, Shapses SA, Taylor CL. IOM Committee members respond to Endocrine Society vitamin
D guideline. J Clin Endocrinol Metab. 2012;97(4):1146–52.
81. Płudowski P, Karczmarewicz E, Bayer M, Carter G, Chlebna-Sokół D, Czech-Kowalska J, Dębski R, Decsi T, Dobrzańska A, Franek E, Głu sz k o P, G ra nt WP, H olic k MF, Ya n k o v s ka ya L, Konstantynowicz J, Książyk JB, Księżopolska-Orłowska K, Lewiński A, Litwin M, Lohner S, Lorenc RS, Łukaszkiewicz J, Marcinowska-Suchowierska E, Milewicz A, Misiorowski W,
Nowicki M, Povoroznyuk V, Rozentryt P, Rudenka E, Shoenfeld Y, Socha P, Solnica B, Szalecki M, Tałałaj M, Varbiro S, Żmijewski MA. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe – recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynol Pol. 2013;64(4):319–27. 502
82. Luxwolda MF, Kuipers RS, Kema IP, Dijck-Brouwer DA, Muskiet FA. Traditionally living populations in East Africa have a mean serum 25-hydroxyvitamin D concentration of 115 nmol/l. Br J Nutr. 2012;108(9):1557–61.
83. El-Hajj Fuleihan G, Nabulsi M, Tamim H, Maalouf J, Salamoun M, Khalife H, Choucair M, Arabi A, Vieth R. Effect of vitamin D replacement on musculoskeletal parameters in school children: a randomized controlled trial. J Clin Endocrinol Metab. 2006;91: 405–12.
84. Donneyong MM, Taylor KC, Kerber RA, Hornung CA, Scragg R. Is outdoor recreational activity an independent predictor of cardiovascular disease mortality - NHANES III? Nutr Metab Cardiovasc Dis. 2016;26(8):735–42.
85. Lindqvist PG, Epstein E, Nielsen K, Landin-Olsson M, Ingvar C, Olsson H. Avoidance of sun exposure as a risk factor for major causes of death: a competing risk analysis of the melanoma in southern Sweden cohort. J Intern Med. 2016;280(4):375–87.
86. Wolpowitz D, Gilchrest BA. The vitamin D questions: how much do you need and how should you get it? J Am Acad Dermatol. 2006;54:301–17.
87. Karimi K, Lindgren TH, Koch CA, Brodell RT. Obesity as a risk factor for malignant melanoma and non-melanoma skin cancer. Rev Endocr Metab Disord. 2016;17(3):389–403.94.
88. Kennedy C, Bajdik CD, Willemze R, de Gruijl FR, Bavinck JN. The influence of painful sunburns and lifetime of sun exposure on the risk of actinic keratoses, seborrheic warts, melanocytic nevi, atypical nevi and skin cancer. J Invest Dermatol. 2003;120(6): 1087–93.
89. Moan J, Porojnicu AC, Dahlback A, Setlow RB. Addressing the health benefits and risks, involving vitamin D or skin cancer, of increased sun exposure. Proc Natl Acad Sci U S A. 2008;105(2): 668–73.
90. Felton SJ, Cooke MS, Kift R, et al. Concurrent beneficial (vitamin D production) and hazardous (cutaneous DNA damage) impact of repeated low-level summer sunlight exposures. Br J Dermatol. 2016;175:1320–8.
91. Holick MF. Can you have your cake and eat it too? The sunlight Dlema. Br J Dermatol. 2016;175:1129–31.
92. Brot C, Vestergaard P, Kolthoff N, Gram J, Hermann AP, Sorensen OH. Vitamin D status and its adequacy in health Danish perimenopausal women: relationships to dietary intake, sun exposure and serum parathyroid hormone. Brit J Nutr. 2001;86:S97–103.
93. Baggerly C, Cuom R, French C, Garland C, Gorham E, Grant W, Heaney R, Holick M. Sunlight and vitamin D: necessary for public health. J Am Coll Nutr. 2015;34(4):359–65.
94. Osmancevic A, Gillstedt M, Landin-Wilhelmsen K, Wennberg Larko AM, Larko O, Holick M, Krogstad AL. Size of the exposed body surface area, skin erythema and body mass index predict skin production of vitamin D. 2015 June. J Photochem Photobiol B Biol. 2015;149:224–9.
95. Vieth R. The Pharmacology of Vitamin D, including fortification strategies. Chapter 61 in Vitamin D, 2 Edition. D Feldman, JW Pike, FH Glorieux eds. Elsevier Acad. Press 30 Corporate Dr., Suite 400, Burlington, MA 01803. 2005. pp 995–1015.
96. Rich-Edwards JW, Davaasambuu G, Kleinman K, Sumberzul N, Holick MF, Lkhagvasuren T, Dulguun B, Burke A, Frazier AL. Randomized trial of fortified milk and supplements to raise 25- hydroxyvitamin D concentrations in schoolchildren in Mongolia. Am J Clin Nutr. 2011;94:578–84.99
文章来源:老汪帮你看化验单,版权归原作者所有,如有侵权,请联系我们及时删除。